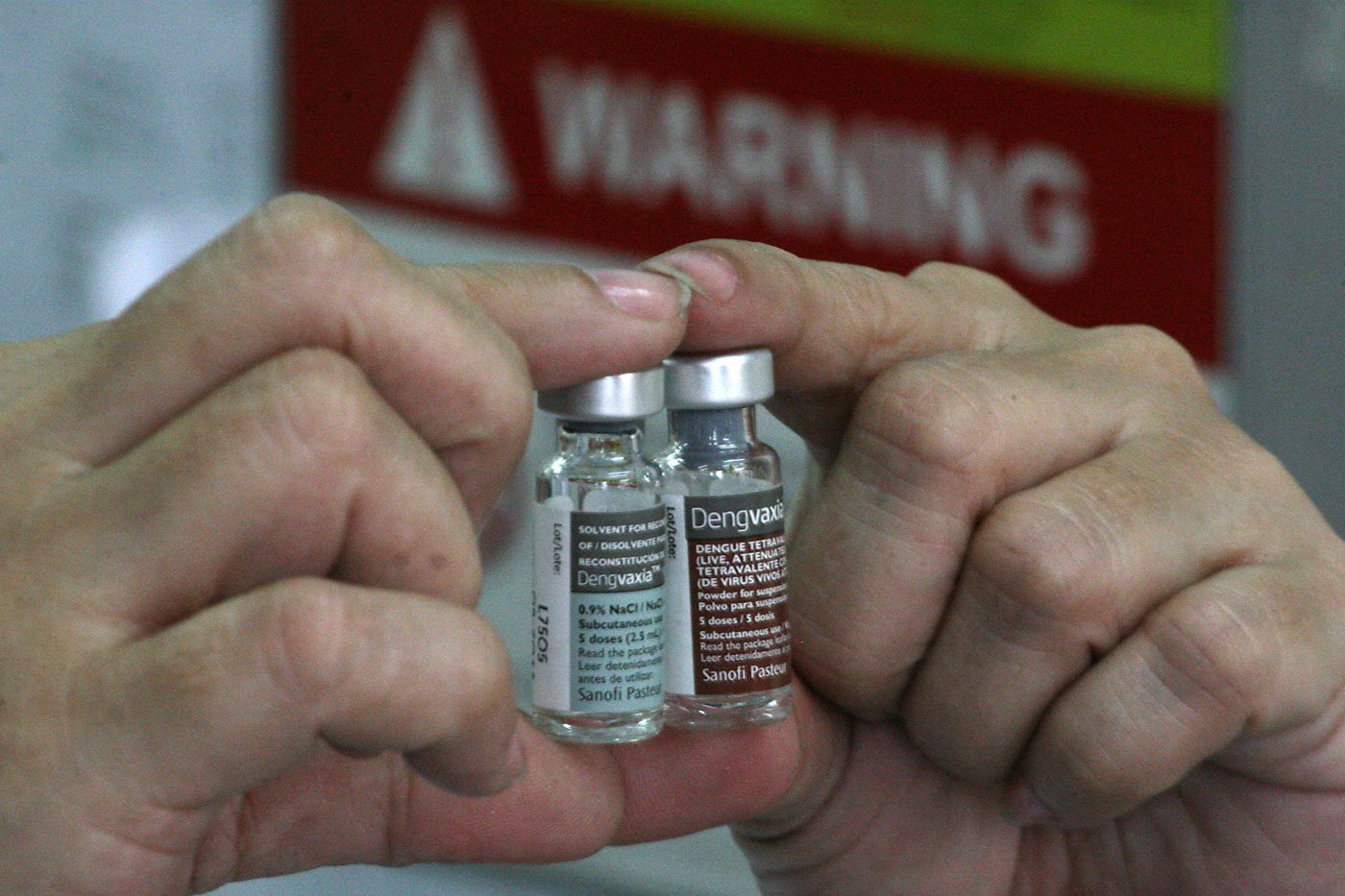
Mantan kepala regulasi obat FDA memberikan ‘akomodasi’ khusus kepada Sanofi untuk Dengvaxia
keren989
- 0
Ini adalah ringkasan yang dibuat oleh AI, yang mungkin memiliki kesalahan. Untuk konteksnya, selalu rujuk artikel selengkapnya.
(DIPERBARUI) Mantan Pusat Regulasi dan Penelitian Obat Benjamin Co menerima USB langsung dari Sanofi ketika memberikan USB langsung kepadanya. Hal ini tidak diperbolehkan berdasarkan peraturan FDA
MANILA, Filipina (UPDATE ke-2) – Kepala Badan Pengawas Obat dan Makanan (FDA) saat ini mengatakan mantan direktur regulasi dan penelitian obat memberikan “akomodasi” khusus kepada pembuat Dengvaxia Sanofi Pasteur.
Direktur Jenderal FDA Nela Charade Puno mengatakan kepada anggota parlemen pada hari Senin, 26 Februari, bahwa mantan direktur Pusat Regulasi dan Penelitian Obat (CDRR) Benjamin Co menerima drive USB langsung dari Sanofi.
Peraturan FDA melarang perusahaan memberikan materi langsung kepada evaluator lembaga tersebut. Sebaliknya, FDA memiliki pusat tindakan terpisah di mana perusahaan harus menyerahkan dokumennya.
USB tersebut berisi tanggapan Sanofi terhadap Co, yang pada bulan April 2017 menunjukkan beberapa pelanggaran yang dilakukan oleh raksasa farmasi Prancis tersebut terhadap peraturan FDA tentang otorisasi pasca pemasaran.
Laporan Co pada bulan April 2017 menjadi dasar penangguhan satu tahun FDA dan denda P100.000 terhadap Sanofi.
Puno mengatakan hubungan langsung Co dengan Sanofi ditemukan oleh Satuan Tugas Dengvaxia FDA, yang dibentuk setelah Departemen Kesehatan (DOH) menghentikan program imunisasi demam berdarah berbasis sekolah. Sanofi mengungkapkan, vaksin tersebut berisiko bagi orang yang belum tertular demam berdarah.
“Saya berasumsi bahwa Dr. Benjie Co melakukan tugasnya dengan memantau secara ketat penyampaian laporan pasca pemasaran (Sanofi). Yang terjadi adalah kami harus menyelidiki dan kami menemukan beberapa hal yang ada keraguan dalam hal pengajuan atau menghibur atau mengakomodasi Sanofi,” kata Puno saat DPR melanjutkan penyelidikannya atas kontroversi Dengvaxia.
Dia mengatakan gugus tugas menemukan bahwa “akomodasi (oleh Co) diberikan kepada Sanofi dan (diizinkan) ketidakpatuhan terhadap persyaratan standar.” Hal ini termasuk melarang komunikasi langsung antara perusahaan dan pengulas FDA.
Johnny Pimentel, ketua panel pemerintahan yang baik dan akuntabilitas publik DPR, kemudian bertanya kepada Puno apakah dia menyindir bahwa Co memberikan “perlakuan khusus” kepada Sanofi. Dia setuju.
“Iya Pak, kalau dilihat semua keadaannya, begini kesimpulannya,” kata Puno.
Co tidak diundang ke sidang DPR dan karena itu tidak dapat membela diri di hadapan anggota parlemen.
Namun pengacaranya Joseph Estrada menjelaskan kepada Rappler bahwa Sanofi memberikan USB tersebut kepada Co karena DOH Francisco Duque III menginginkan salinan awal dari presentasi perusahaan mengenai penerapan pelabelan ulang Dengvaxia.
“Ketika Anda pergi ke sana dari Sanofi untuk menyerahkan USB hari itu, itu melanggar surat edaran yang mengatakan FDA tidak dapat melakukan transaksi langsung.kata Estrada.
Duque telah mencopot Co dari jabatannya sebagai direktur CDRR minggu lalu dan menempatkannya kembali di bawah kantor Puno sementara FDA dan DOH menyelidiki kekacauan Dengvaxia. Co akan mengajukan banding resmi.
Dalam pernyataan terpisah, Estrada mengatakan keringanan Co disebabkan oleh dugaan kegagalannya menyerahkan salinan uang muka.
“Namun, kegagalan tersebut paling banyak merupakan kesalahan prosedural di pihak Dr. Co karena melanggar Memorandum FDA 2017-015 dengan menerima salinan lanjutan permohonan pelabelan ulang kepada stafnya,” kata Estrada.
Dia menambahkan bahwa hal itu tidak mengurangi tinjauan FDA yang sedang berlangsung terhadap penerapan pelabelan ulang Sanofi pada saat itu.
“Ketika hal ini terjadi, Dengvaxia sudah ditangguhkan dari pasar dan Sanofi diperintahkan untuk menyerahkan berkas lengkap rekomendasinya. Salinan dengan Dr Co adalah salinan lanjutan,” kata Estrada.
Penjabat Wakil Direktur Jenderal Kantor Operasi Regulasi Lapangan FDA Maria Lourdes Santiago juga ditugaskan kembali di bawah kantor Puno.
Dia adalah pejabat FDA yang bertanggung jawab ketika lembaga tersebut mengizinkan Sanofi menjual Dengvaxia di Filipina pada 22 Desember 2015.
Dalam sidang yang sama, Puno dan dokter Anthony Leachon mengatakan dokumen membuktikan bahwa Sanofi sudah mengetahui risiko vaksinnya sejak tanggal 22 Desember 2015, namun tidak mengungkapkannya kepada pemerintah Filipina. – Rappler.com
Catatan Editor: Versi awal artikel ini menyebutkan USB yang diberikan kepada Co terkait dengan permohonan Sanofi untuk sertifikat registrasi produk Dengvaxia. Ini telah diperbaiki agar mengarah ke dokumen yang benar.
